Tratamientos que crean edema periférico, los conocidos y los menos conocidos
Rubio López JM, Varea Ortiz MªC
Especialistas en MFyC. CS Martos (Jaén)
Recibido el 16-01-2022; aceptado para publicación el 01-04-2022.RESUMEN
Las cascadas terapéuticas son actuaciones que se realizan de manera no intencionada y la mayoría de las veces no se conocen. Podríamos definir una cascada como la prescripción para contrarrestar los efectos adversos de una medicación anteriormente prescrita.
De esta manera cuando prescribimos un medicamento para una determinada condición o signo clínico, lo realizamos con intención de mejorar la morbimortalidad en ese paciente. A veces no es así, o si es así, pero crea un evento clínico nuevo. Es decir, que mejora el estadio clínico de una enfermedad, pero crea un efecto secundario que puede ser que no sea asumido por parte del paciente. De esta manera sino tenemos una destreza médica apropiada o bastante entrenada, podemos interpretar este nuevo signo clínico como uno nuevo en el curso evolutivo de su enfermedad creando la necesidad de una nueva prescripción. La nueva prescripción no exenta de riesgos puede aumentar la iatrogenia, así como las interacciones entre los medicamentos que el paciente toma habitualmente.
Con este artículo hacemos una revisión del edema periférico causado por medicamentos, así como la cascada terapéutica creada por el uso de un medicamento. Se hace mención y se advierte de una idea que debe de estar en el subconsciente en la práctica médica habitual.
Cascadas de prescripción y efectos secundarios
La cascada de prescripción puede definirse como la nueva prescripción que se produce cuando se prescribe un nuevo fármaco para el tratamiento de una reacción médica adversa asociada a otro medicamento. En la mayoría de los casos se entiende esta nueva prescripción con la intención de tratamiento de un nuevo síntoma de una nueva o antigua patología subyacente.
Otro hecho posible es la presencia de una combinación de medicamentos puede desencadenar una cascada terapéutica. Esta circunstancia sugiere que debe iniciarse un proceso de desprescripción o debe reducirse la dosis de medicamentos. También puede haber en la cascada terapéutica la posibilidad de potenciales efectos secundarios con efectos no deseados. Normalmente la presencia de una cascada de prescripción es inadecuada y aumenta la morbilidad del paciente (1). La identificación y la interrupción de cascadas de prescripción es un hecho importante, que requiere un mero proceso y es una oportunidad extraordinaria para mejorar la seguridad de la prescripción del paciente (2).
El médico puede hacer tres preguntas para identificar e interrumpir las cascadas de prescripción para reducir el riesgo de eventos adversos prevenibles.
- Primero, ¿se está recetando un nuevo medicamento para abordar un evento adverso de un tratamiento farmacológico prescrito previamente? Antes de comenzar una terapia con medicamentos para tratar una nueva condición médica, debe considerarse si esta condición o signo clínico o síntoma, podría ser un evento adverso relacionado con el medicamento. Además, debe de investigarse si el paciente está tomando algún medicamento no prescrito o si el paciente está usando algún remedio para paliar algún síntoma no deseado.
- Segundo, ¿es realmente necesaria la farmacoterapia inicial que condujo a la cascada de prescripción? ¿Es absolutamente necesaria la terapia inicial con medicamentos, se podía sustituir el medicamento inicial por una alternativa más segura o se podía reducir la dosis y, por lo tanto, reducir la necesidad de una terapia farmacológica posterior?
- Finalmente: ¿Cuáles son los daños y beneficios de continuar la terapia con medicamentos que condujo a la cascada de prescripción?
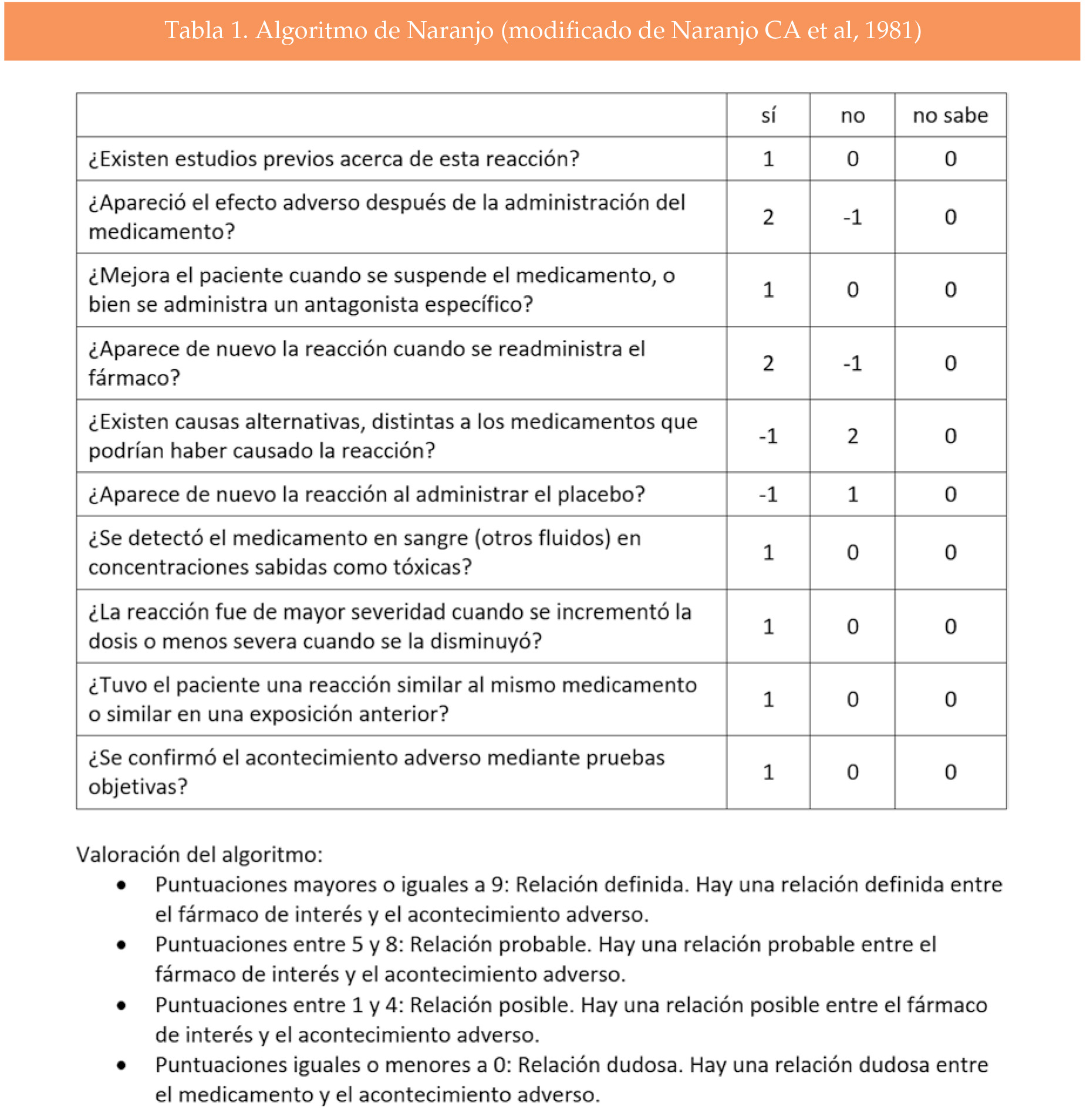
Para la ayuda de identificación de este problema contamos con la ayuda de la Escala de Naranjo (3). (véase tabla 1). El algoritmo de Naranjo fue desarrollado en el año 1981 en la Universidad de Toronto y nos ayuda a manejar la causalidad de las reacciones adversas de medicamentos. Su aplicación consta de 10 preguntas con respuesta sí o no. La identificación de una medicación que crea un efecto secundario debe de ser retirada o sustituida.
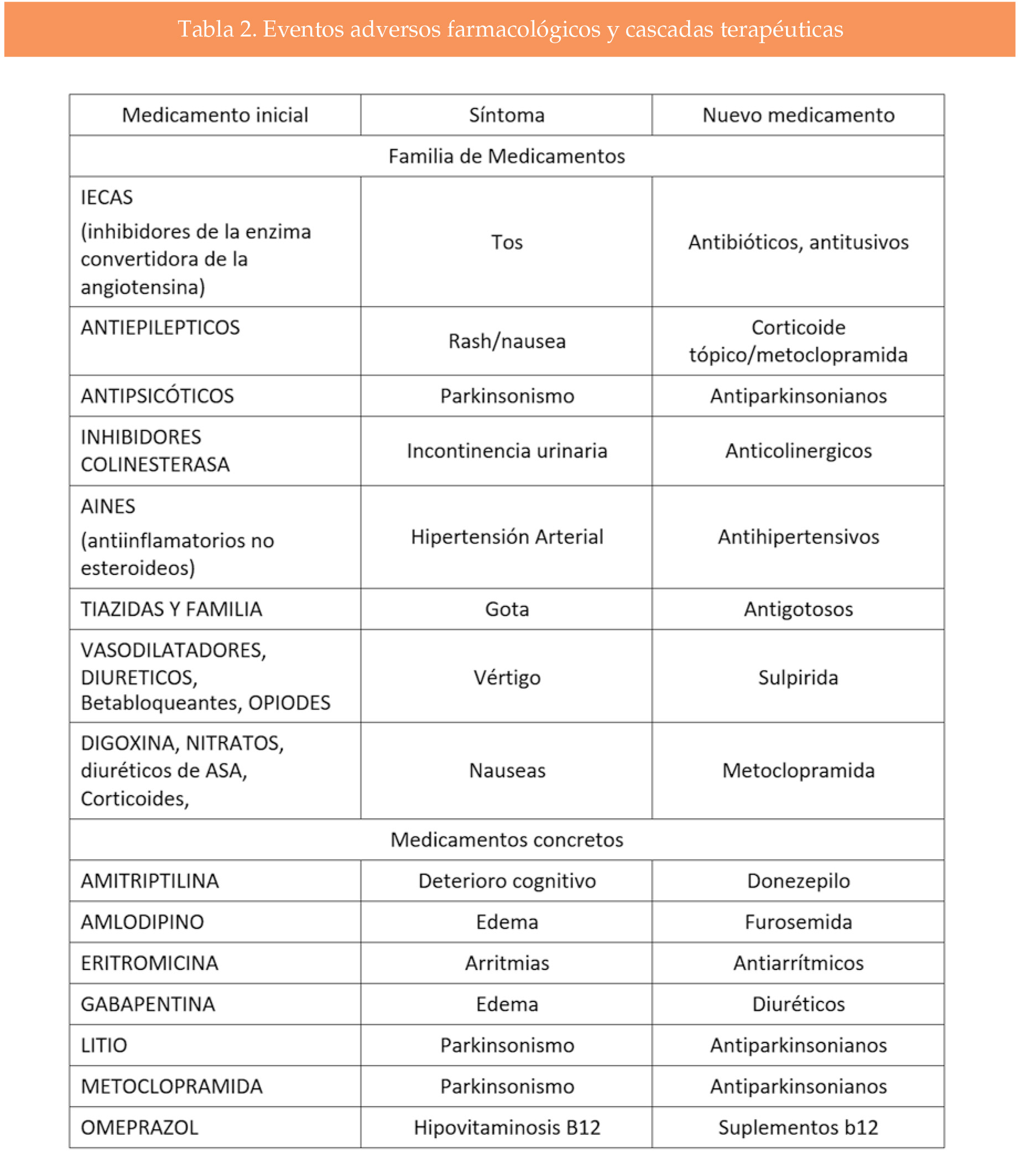
En este artículo hablaremos de la cascada terapéutica relacionada con el edema periférico, pero existen otras que deben de ser ampliamente conocidas por el Médico de Atención Primaria (4).
Edema periférico
Se define el edema periférico como la hinchazón causada por el exceso de líquido atrapado en los tejidos del cuerpo. Se debe al aumento del líquido en el espacio intersticial debido a la autorregulación de los componentes del músculo liso de las arteriolas precapilares. Si bien el edema puede afectar cualquier parte del cuerpo, se puede observar con mayor frecuencia en las zonas más declives, tobillos, extremidades inferiores, testículos o manos (7). Hay cuatro mecanismos esenciales por los cuales se crea un edema periférico:
- Vasodilatación de las arteriolas a nivel precapilar (considerado este como edema por vasodilatación),
- Retención de agua y sal (edema renal),
- Por insuficiencia linfática (linfedema), y
- Por aumento de la permeabilidad capilar (edema permeable) (5).
Otros manuales clasifican la fisiopatología del edema periférico relacionado con los vasodilatadores en
- La vasodilatación arteriolar aumenta la presión intracapilar, exudando líquido hacia el intersticio.
- Muchos vasodilatadores estimulan el sistema renina-angiotensina aldosterona.
- El riñón percibe cualquier caída de la presión arterial como una disminución de la plenitud de la circulación, la interpreta erróneamente como debida a la depleción de volumen y, en un intento por restaurar el llenado arterial, paradójicamente retiene sodio.(6)
El edema periférico es una entidad bastante frecuente en la actualidad y suele estar presente, entre otros, en paciente hipertensos con mal control o con medicación no apropiada, en pacientes con insuficiencia cardiaca, insuficiencia venosa o trombosis venosa profunda.
Debe de explorarse detenidamente al paciente, así como considerar un amplio abanico de posibilidades antes de someter al paciente a una gran cantidad de diagnósticos y pruebas complementarias no necesarias. El diagnostico de insuficiencia venosa es ampliamente atribuido sin considerar otras posibles etiologías. Entre las posibles causas que no son normalmente pensadas en un diagnóstico diferencial inicial se cuentan la apnea del sueño, debido a que cambia las presiones de llenado cardiaco del lado derecho impidiendo el correcto retroceso del retorno venoso a la aurícula derecha por la vena cava inferior, y la propia medicación del paciente.
El edema periférico es una entidad frecuente en las cascadas terapéuticas. La cascada terapéutica se produce cuando se prescribe un nuevo medicamento para «tratar» una reacción adversa asociada con otro medicamento, basándose esta prescripción farmacológica en la creencia errónea de que una nueva condición médica que requiere tratamiento se ha instaurado(8)).
Bloqueantes de los canales del calcio
Los bloqueadores de los canales de calcio dihidropiridínicos también se consideran generalmente seguros porque no requieren un control rutinario de electrolitos o función renal, ni causan diuresis. Los canales de calcio se clasifican en los tipos L, T, N y P, de acuerdo con su cinética de activación, la especificidad de los iones y la sensibilidad a fármacos y a toxinas. Según el estímulo que permite la entrada del calcio, pueden ser voltaje-dependientes o receptor-dependientes.
No obstante, es ampliamente conocido el edema periférico creado por los antagonistas del calcio dihidropiridinicos (DH-CCB), en especial en nuestro entorno por el amlodipino. Los bloqueadores de los canales del calcio (CCB) de dihidropiridina son el segundo grupo famracológico más frecuente, después de los dilatadores arteriolares (por ejemplo, minoxidil, hidralazina), en causar edema vasodilatador en pacientes que reciben terapia antihipertensiva. El edema inducido por CCB es causado principalmente por el aumento de la presión hidrostática capilar que resulta de una mayor dilatación de los vasos precapilares que postcapilares. Este efecto puede estar mediado, en parte, por la mayor sensibilidad a la resistencia de los vasos. La capacitancia reducida es inducida por los CCB en la reactividad vascular miogénica. Esta reducción de la capacitancia puede verse en génesis de falta de control de los cuadros de hipotensión ortostática.
El edema creado por los fármacos calcioantagonistas no tiene un efecto clase y hay diferencia en cuanto a la incidencia de este problema con este grupo de medicamentos, de manera que es más frecuente con amlodipino y menos con nicardipino y manidipino (1/3 de las veces que lo hace el amlodipino)(9). Los antagonistas del calcio provocan la aparición de edemas debido a la vasodilatación arterial y la retención renal de sodio.
Los diuréticos de asa se han utilizado de forma inapropiada para tratar el edema de los miembros inferiores asociado a los DH-CCB, lo que constituye una cascada de prescripción. (10). Hay que tener en cuenta que el edema inducido por bloqueantes de los canales del calcio no es causado por la sobrecarga de líquidos. El tratamiento de este signo con diuréticos en pacientes euvolémicos crea problemas tales como desequilibrios electrolíticos, incontinencia urinaria, cuadros de hipotensión y caídas. Por el contrario, el tratamiento de elección para el edema inducido por los DH-CCB incluye la reducción o interrupción de la dosis de estos fármacos, lo que habitualmente reduce o resuelve completamente el edema. (11)
Las afirmaciones de que los CCB de acción prolongada de tercera generación se asocian con tasas más bajas de edema que los medicamentos más antiguos han sido investigadas en varios ensayos clínicos. Sin embargo, cuando los pacientes lo informan como “hinchazón de la pierna”, uno de estos bloqueadores de los canales del calcio de tercera generación se ha asociado con una incidencia de edema del 22%. Es evidente que el edema periférico dependiente de la dosis sigue siendo un efecto secundario común en pacientes que reciben CCB tanto clásicos como nuevos. (12)
Pregabalina y gabapentina
Existen otros fármacos que crean esta condición como son prebagalina y la gabapentina, ambos conocidos como gabapentinoides. La bibliografía no es muy amplia respecto al tema, pero la documentación se basa en los datos obtenidos de una cohorte poblacional (1), además de la ficha técnica del producto así como los estudios post comercialización. Si se puede encontrar más literatura sobre el edema y el fallo cardiaco asociado al uso de pregabalina.
En cuanto a la farmacodinámica de ambos, hay diferencias pequeñas en la estructura química de los compuestos anticonvulsivos de unión a las subunidades α2δ de los canales de calcio dependientes de primera y segunda generación son claramente importantes y diferencian las propiedades farmacocinéticas y farmacodinámicas de la pregabalina frente a las de gabapentina. La pregabalina tiene la clara ventaja de una absorción no saturable en dosis clínicamente relevantes, lo que da como resultado una farmacocinética lineal. A continuación, la pregabalina tiene una relación dosis-respuesta más pronunciada que la gabapentina. La pregabalina parece lograr un mayor efecto de tratamiento en la neuralgia postherpética y la epilepsia que la gabapentina.
El conocimiento del mecanismo de acción de cada medicamento, así como sus implicaciones terapéuticas nos harán capaces de identificar este evento y ponerle solución. La gabapentina induce edema en los pacientes siendo este problema aún más frecuente en los pacientes geriátricos (13), siendo habitualmente indicada en el tratamiento del dolor neuropático, fibromialgia y para el dolor de la estenosis espinal. El efecto analgésico de la gabapentina es debido al mimetismo con ácido gamma aminobutírico y al bloqueo de los canales de calcio, mecanismo por el que crea el edema.
La pregabalina se usa para tratar el dolor neuropático, aunque su mecanismo de acción aún no se conoce bien (14). La pregabalina es un antagonista de los canales de calcio que disminuye la liberación de varios neurotransmisores, incluida la sustancia P, la noradrenalina y el glutamato, sin unirse a los receptores GABA (ácido gamma amino butírico). El mecanismo de acción probable del fármaco se basa en su unión a las subunidades α2δ de los canales de calcio dependientes de voltaje en las neuronas presinápticas, que reduce la liberación del neurotransmisor glutamato excitador. El edema periférico puede pasar desapercibido como efecto adverso de la pregabalina, provocando pérdida de movilidad y una estancia hospitalaria prolongada (15).
Además del edema periférico, la pregabalina puede provocar un empeoramiento de los síntomas de insuficiencia cardíaca. Estos efectos pueden ser el resultado del antagonismo del canal de calcio de tipo L en la vasculatura que causa vasodilatación, similar al mecanismo de acción de los bloqueadores de los canales de calcio utilizados para tratar la hipertensión. El desarrollo del edema de extremidades en los pacientes que se encuentran bajo tratamiento con gabapentinoides puede crear una cascada periférica con la administración de diuréticos de asa para aliviar tal signo (1).
AINES (antiinflamatorios no esteroideos)
Los antiinflamatorios no esteroideos (AINES) son medicamentos de amplio uso en nuestro medio y no exentos de efectos secundarios. Estos efectos secundarios son más importantes cuando existe una comorbilidad de base, así como cuando interaccionan con otros medicamentos. De tal manera que podemos identificar una interacción fármaco-fármaco y/o fármaco-enfermedad. De esta manera, el uso de AINES crea la precipitación de cascadas terapéuticas.
Los antiinflamatorios no esteroideos (AINES), comprometen el filtrado glomerular en pacientes con riesgo aumentado, de tal manera que crean en los pacientes hipertensión arterial y edema periférico. Cuando la hemodinámica renal está comprometida, como en pacientes con depleción de volumen, las prostaglandinas tienen un completo efecto en control de la función renal, como en sus efectos vasodilatadores. De tal manera se pueden explicar los efectos por retención de líquidos porque se inhibe la excreción de agua por los riñones. (16)
La evidencia nos señala que los AINES incrementan el riesgo de fallo renal. La insuficiencia renal, incluso en un grado relativamente menor, tiene el potencial de aumentar el riesgo de complicaciones asociadas con la hospitalización además de la morbilidad asociada al ingreso. El fallo renal asociado al consumo de AINES es poco común en personas sanas y en aquellas en la que el riesgo de fallo renal es bajo. Sin embargo, es elevado para los pacientes con alto riesgo de fallo renal por bajo volumen circulante, fallo renal crónico o alteración del filtrado glomerular. En estos pacientes debe de realizarse una monitorización estrecha de la función renal. (17)
Tanto los AINES convencionales como los Inhibidores selectivos de la COX-2 pueden crear complicaciones renales, entre las cuales se incluyen aumento de la presión arterial, edema periférico, retención de sodio e hiperkaliemia. Aun así, todos estos efectos secundarios dependen del tiempo de exposición. (18)
Los factores de riesgo preexistentes para los eventos adversos por medicamentos son, disfunción renal o hepática, síndrome nefrótico con alto grado de proteinuria en orina, edad adulta, diabetes, hipertensión, necrosis papilar y fallo cardiaco congestivo. Existen factores estresantes agudos que pueden complicar una función renal comprometida como puede ser la deshidratación creada por el calor, ejercicio físico extenuante, esta noxa puede complicar un sistema fisiológico que está comprometido. (19) En pacientes ancianos con diagnóstico de hipertensión arterial, el tratamiento con AINES tanto como prostaglandina-endoperóxido sintasa 2 (COX-2), promueve la formación de edema periférico y elevación de la tensión arterial.
Existe una interacción farmacológica muy importante, conocida como Triple Whammy, en la que intervienen los AINES en los pacientes hipertensos. La Triple Whammy es un fallo agudo prerrenal desencadenado por alteración hemodinámicas a nivel renal que reducen la tasa de filtrado glomerular sin crear una alteración en el parénquima renal. Los inhibidores del sistema renina angiotensina, los inhibidores de los antagonistas de los receptores de la angiotensina 2 (ara 2), los AINEs y los diuréticos, son medicamentos que pueden y algunas veces son prescritos de manera simultánea, y son capaces de crear alteración de la función renal. La combinación de los fármacos anteriores, daña el equilibrio regulador de la presión arterial (así como la presión de perfusión renal) y el filtrado glomerular.(20)
INHIBIDORES DE LA COLINESTERASA
Se ha publicado que el uso de los inhibidores de la acetilcolina tiene genera un riesgo de aparición de edema periférico con una Odds Ratio de 2,08, aunque este dato está catalogado como de poca evidencia en una revisión de la revista Cochrane y. (21) Los eventos adversos que ocurren con una incidencia de al menos 2% en los pacientes tratados con placebo y que es igual o mayor con la galantamina son estreñimiento, agitación, confusión, ansiedad, alucinaciones, lesión, dolor de espalda, edema periférico, astenia, dolor en el pecho, incontinencia urinaria, infección del tracto respiratorio superior, bronquitis, tos, hipertensión, caídas, y púrpura. Muchos de estos eventos suelen ocurrir en los pacientes de Alzheimer, independientemente de los tratamientos farmacológicos.
La aparición de edemas periféricos también ha sido descrita con el uso de agonistas de la dopamina en el síndrome de piernas inquietas y también con otros fármacos no dopaminérgicos como amantadina, que también es un tratamiento para la Enfermedad de Alzheimer (EA).
Hoy no está aclarada la fisiopatología de este efecto secundario que se versa en este documento, sin embargo, como la dopamina es un regulador del tono del sistema simpático, de la secreción de aldosterona y tiene efectos en canales de Na -K+ mediados por adenosina trifosfato, el efecto de los agonistas a estos niveles puede influir en la aparición de edema periférico. Para el desarrollo de este se han descrito factores de riesgo como puede ser la cardiopatía coronaria.
Un paciente que toma un inhibidor de la colinesterasa para el tratamiento de la demencia puede desarrollar incontinencia urinaria como efecto secundario. Si este efecto secundario pasa desapercibido por el médico prescriptor como una posible iatrogenia de los inhibidores de la colinesterasa, puede prescribir un anticolinérgico creando una cascada terapéutica potencialmente peligrosa. Es importante tener en cuenta esta reacción adversa, no muy conocida en nuestro medio, para evitar someter a los pacientes a estudios injustificados, además que es reversible con la conducta terapéutica adecuada.
Se ha descrito una reactividad microvascular cutánea alterada en la EA, lo que sugiere que la reactividad microvascular cutánea podría ser útil en el diagnóstico de la EA. Existe una respuesta vasodilatadora de la piel reducida a la iontoforesis de acetilcolina en pacientes no tratados con EA leve en comparación con sujetos de control, mientras que también se ha encontrado una respuesta significativamente mayor en pacientes tratados con donepezilo en comparación con pacientes con EA no tratados (22). Entendiendo mejor el aspecto de la fisiopatología de la EA a nivel periférico se puede entender mejor la vasodilatación creada por los inhibidores de la acetilcolina.
En los pacientes con EA se ha demostrado un deterioro en la respuesta noradrenérgica a la ortostasis y se ha observado una respuesta vascular de la piel atenuada a las sustancias colinérgicas iontoforizadas en la piel. Estas alteraciones vasorreguladoras son consistentes con el hallazgo de que las neuronas centrales que regulan la PA degeneran en la Enfermedad de Alzheimer. Los núcleos autonómicos, colinérgicos y otros del tronco encefálico (p. ej., el núcleo parabraquial implicado en el control homeostático y la integración de la información visceral) también se encuentran afectados en la Enfermedad de Alzheimer. Estos hallazgos también podrían respaldar las disfunciones autonómicas en pacientes con Enfermedad de Alzheimer, incluidas las alteraciones cardiovasculares parasimpáticas y simpáticas. La vasodilatación activa cutánea es una función del sistema nervioso simpático mediada por nervios colinérgicos. (23)
A nivel vascular podemos entender que la Acetilcolina estimula las células endoteliales vasculares para que liberen óxido nítrico (NO), la disminución de la respuesta a esta sustancia química se considera una prueba de la función endotelial alterada. (24)
AGONISTAS DOPAMINÉRGICOS
Los agonistas dopaminérgicos empleados en el tratmiento de la enfermedad de Parkinson también presentan efectos secundarios causados por varios mecanismos de acción, dependiendo de la composición y características farmacológicas del fármaco, su impacto sobre los receptores dopaminérgicos y no dopaminérgicos, así como de la dosis y duración del tratamiento. Los más importantes incluyen: náuseas y vómitos, hipotonía ortostática, síndromes psiquiátricos, alteraciones del sueño, fibrosis pleuropulmonar y retroperitoneal, propiedades vasoconstrictoras, edema, alteraciones hormonales, así como discinesias.
Para los agonistas de la dopamina, se debe tener en cuenta la evidencia disponible sobre su eficacia sintomática, el efecto sobre las complicaciones motoras relacionadas con la levodopa a largo plazo, el efecto aditivo sobre la progresión de la enfermedad y el perfil de eventos adversos. Recientemente se ha reconocido cada vez más la aparición de eventos adversos como edema en las piernas, somnolencia diurna, trastornos del control de los impulsos y fibrosis. Por lo tanto, debe existir una valoración cuidadosa del balance riesgo/beneficio en la prescripción de este grupo farmacológico.
Las enfermedades comórbidas son factores de riesgo importantes para el desarrollo de somnolencia, edema y alucinaciones. Al iniciar el tratamiento con pramipexol, se debe asesorar a los pacientes sobre la somnolencia y el edema, y realizar una vigilancia activa. Ligeras disminuciones en la función cognitiva y la edad avanzada se asocian con un mayor riesgo de alucinaciones.
Efectos adversos como el dolor en las articulaciones o artralgia (1%-23,6%), diarrea (1%- 9,1%), edema (1,8%-37%), dolor de cabeza (4%-24,5%), estreñimiento (1,3%-20%), fatiga o cansancio (3,4%-11,3%), insomnio (1%-27%), dolor de espalda o generalizado (1,9%-28%) y vómitos (1%-12%) se presentan en una frecuencia media próxima al 10% y aparecen prácticamente con el uso de cualquiera de los tratamientos antiparkinsonianos. De la misma forma, mareos (1%-26,8%) y somnolencia o sedación (1,3%-53,7%) se presentan también en todos los tratamientos, pero con una frecuencia ligeramente superior entorno al 15% de los pacientes.
MEDICAMENTOS PARA LA DIABETES
El edema, periférico o generalizado, es una complicación rara de la terapia con insulina, que ocurre principalmente después de iniciar un tratamiento intensivo con insulina en pacientes con diabetes recién diagnosticada o mal controlada. Los casos de esta rara afección han seguido surgiendo incluso en los últimos años, a pesar de las grandes mejoras en la química y la fabricación de moléculas de insulina.(25)
La mayoría de los casos notificados de edema insulínico se han producido en pacientes con diabetes tipo 1 que normalmente se presentan después de comenzar con insulina o la intensificación de los regímenes de insulina. La deficiencia de insulina da lugar a un estado catabólico, que potencia el desarrollo del edema. Se ha demostrado que la hiperglucemia crónica en estado catabólico aumenta la permeabilidad capilar a través de la fuga de albúmina al líquido intersticial. La producción de GnRH y estrógenos contribuye a una mayor vasodilatación. Se ha sugerido que el estrés crónico durante el estado catabólico de deficiencia de insulina se relaciona con la disfunción del generador de pulsos de la hormona liberadora de gonadotropina en el hipotálamo, que es responsable de la alta incidencia de trastornos menstruales en pacientes con diabetes tipo 1. Con la terapia con insulina, el estado catabólico se normaliza, reanudando la producción de gonadotropinas y estrógenos. Esto puede causar la síntesis de óxido nítrico inducida por estrógenos en las células endoteliales, lo que conduce a la rápida vasodilatación de los lechos capilares y la exacerbación del tercer espacio de fluidos. (26)
La acción de la insulina promueve la retención de sodio contribuyendo al estado edematoso. La terapia con insulina promueve la reabsorción de sodio en los túbulos renales al estimular la Na+/K+-ATPasa, así como la expresión del intercambiador 3 de Na+/H+ en el túbulo proximal y se equilibra con glucagón, que sirve para aumentar la natriuresis en los túbulos distales. Las acciones de la insulina cuando se reintroduce en el estado de deficiencia de insulina conducen a la promoción de la retención de sodio y la inhibición de la natriuresis por la supresión del glucagón. Esta retención de sodio junto con el aumento de la permeabilidad capilar trabaja en conjunto para promover el estado edematoso.
La familia de tiazolidinedionas (TZD) de agonistas del receptor γ activado por el proliferado de peroxisomas proporcionó inicialmente una opción terapéutica prometedora en la DM2 debido a la eficacia antidiabética combinada con efectos cardiovasculares beneficiosos pleiotrópicos.
Son agonistas del receptor nuclear γ activado por el proliferador de peroxisomas (PPAR). El PPAR es un miembro de la superfamilia de receptores de hormonas nucleares: estos son reguladores transcripcionales activados por ligandos de la expresión génica relacionados con el metabolismo de la glucosa y las grasas, la adipogénesis y una serie de vías cardiovasculares e inflamatorias.
Un reciente informe comunica la aparición de edemas en pacientes con diabetes tipo 2 que toman TZD. La gravedad del edema suele ser leve y afecta a las extremidades, sin afectar el torso y la cara. La resolución generalmente se observa después de una o dos semanas de tratamiento conservador con restricción de líquidos y sal y puede ser necesario o no el uso de diuréticos. Los casos graves con anasarca generalizada, derrames pleurales y ascitis son poco frecuentes.
Las tiazolidinedionas causan retención de líquidos en personas con diabetes o prediabetes. Varios mecanismos pueden ser la base del desarrollo del edema periférico. Las TZD exhiben algunas propiedades de antagonismo de los canales de calcio de tipo L muy similares a los bloqueadores de los canales de calcio de dihidropiridina, y pueden causar edema periférico por mecanismos similares. También se ha demostrado que las TZD aumentan la expresión del factor de crecimiento del endotelio vascular, anteriormente conocido como factor de permeabilidad vascular, que induce la permeabilidad microvascular que puede contribuir al edema periférico en ausencia de anomalías cardíacas. (23) La insulina misma ha sido se sabe desde hace décadas que contribuye al riesgo de edema periférico, y la mejora en la sensibilidad a la insulina asociada con el uso de TZD puede causar edema a través de acciones sobre la reabsorción de sodio a nivel del riñón, y también posiblemente al aumentar la vasodilatación mediada por insulina.(30)
Algunos medicamentos de esta clase se han relacionado con el aumento de las muertes cardíacas por este efecto secundario de retención de líquido a nivel intersticial. (27)
La carga mundial cada vez mayor de insuficiencia cardíaca congestiva (ICC) y diabetes mellitus tipo 2 (DM2), así como su coexistencia, requiere que la farmacoterapia antidiabética module el riesgo cardiovascular inherente a la DM2 y cumpla con las restricciones que acompañan impuestas por CHF.
La utilidad de las TZD en DM2 ha disminuido en la última década, en gran parte debido a los efectos adversos concomitantes de retención de líquidos y formación de edema atribuidos a los efectos de retención de sal en la nefrona. Además, esta clase de antidiabéticos causa retención de líquidos que puede promover insuficiencia cardíaca congestiva (28). La manifestación clínica de insuficiencia cardíaca ocurre con más frecuencia con el tratamiento con pioglitazona o rosiglitazona que con otros medicamentos antidiabéticos orales.(29)
CONCLUSIONES Y RECOMENDACIONES
El edema periférico puede ser entendido como un aumento del líquido en el espacio intersticial en las zonas más declives, tobillos, extremidades inferiores, testículos o manos. La competencia médica en saber hacer, conocer y ser consciente cuándo aplicar un protocolo o una guía de práctica clínica puede ser algo muy valioso y diferenciador para el Médico de Atención Primaria. Conocer si tu paciente con Insuficiencia Cardiaca y lumbalgia, que está recibiendo altas dosis de pregabalina, puede crear un edema por este tratamiento es algo de vital importancia para el paciente, para el médico y para el sistema sanitario.
El edema periférico es una entidad bastante frecuente en la actualidad. La etiología del edema periférico es muy variada, desde la insuficiencia cardiaca hasta la insuficiencia venosa pasando por la trombosis venosa profunda. Se define el edema periférico como la hinchazón causada por el exceso de líquido atrapado en los tejidos del cuerpo. En este documento nos hemos referido al edema, en la tabla se exponen otros ejemplos de efectos adversos frecuentes provocados por tratamientos farmacológicos que pueden originar una cascada terapéutica.
El fallo renal asociado al consumo de AINES es poco común en personas sanas y en aquellas que el riesgo de fallo renal es bajo. Sin embargo, para los pacientes con alto riesgo de fallo renal, como son aquellos con bajo volumen circulante, fallo renal crónico o alteración del filtrado glomerular. En estos pacientes debe de realizarse una monitorización estrecha de la función renal. Por eso la prescripción debe de manera sosegada, siendo este una parte de la entrevista y de la consulta principal. Al igual que son los algoritmos de desprescripción y otras muchas herramientas que evitar la iatrogenia y mejoran la morbimortalidad.
El conocimiento del mecanismo de acción de cada medicamento, así como sus implicaciones terapéuticas, nos hará capaces de identificar este evento y ponerle solución. El estudio pormenorizado de los medicamentos que usamos es algo principal para una correcta prescripción por parte del médico.
Bibliografía
- Read SH, Giannakeas V, Pop P, Bronskill SE, Herrmann N, Chen S, et al. Evidence of a gabapentinoid and diuretic prescribing cascade among older adults with lower back pain. J Am Geriatr Soc. 2021;69(10):2842–50.
- Rochon PA, Petrovic M, Cherubini A, Onder G, O’Mahony D, Sternberg SA, et al. Polypharmacy, inappropriate prescribing, and deprescribing in older people: through a sex and gender lens. Lancet Heal Longev. 2021;2(5):e290–300.
- Naranjo CA, Busto U, Sellers EM, Sandor P, Ruiz I, Roberts EA, et al. A method for estimating the probability of adverse drug reactions. Clin Pharmacol Ther [Internet]. 1981 ;30(2):239–45.
- Rochon PA, Gurwitz JH. Optimising drug treatment for elderly people: The prescribing cascade. Br Med J. 1997 ;315(7115):1096–9.
- Largeau B, Cracowski JL, Lengellé C, Sautenet B, Jonville-Béra AP. Drug-induced peripheral oedema: An aetiology-based review. Br J Clin Pharmacol. 2021;87(8):3043–55.
- Schrier RW. Pathogenesis of Sodium and Water Retention in High-Output and Low-Output Cardiac Failure, Nephrotic Syndrome, Cirrhosis, and Pregnancy.1988;319(16):1065–72.
- Edema periférico. Mayo Foundation for Medical Education and Research (MFMER). New York.2022. 2022. https://www.mayoclinic.org/es-es/diseases-conditions/edema/symptoms-causes
- Tomás F, Núñez P, Cifuentes FT. Prescripción en Cascada y Desprescripción. Rev Clínica Med Fam. 2012;5(2):111–9.
- Shetty R, Vivek G, Naha K, Tumkur A, Raj A, Bairy KL. Excellent Tolerance to Cilnidipine in Hypertensives with Amlodipine – Induced Edema. N Am J Med Sci. 2013;5(1);47-50.
- Vouri SM, van Tuyl JS, Olsen MA, Xian H, Schootman M. An Evaluation of a Potential Calcium Channel Blocker – Lower Extremity Edema – Loop Diuretic Prescribing Cascade. J Am Pharm Assoc (2003). 2018 [cited 2021 Dec 31];58(5):534.
- Vouri SM, Jiang X, Manini TM, Solberg LM, Pepine C, Malone DC, et al. Magnitude of and Characteristics Associated With the Treatment of Calcium Channel Blocker–Induced Lower-Extremity Edema With Loop Diuretics. JAMA Netw Open. 2019;2(12):e1918425.
- de la Sierra A. Mitigation of calcium channel blocker-related oedema in hypertension by antagonists of the renin–angiotensin system. J Hum Hypertens 2009 238. 2009;23(8):503–11.
- Kanbay M, Kaya A, Bozalan R, Aydogan T, Uz B, Isik A, et al. Gabapentin induced edema in A geriatric patient. Clin Neuropharmacol. 2006 [cited 2021 Nov 27];29(3):186.
- Ho JM, Tricco AC, Perrier L, Chen M, Juurlink DN, Straus SE. Risk of heart failure and edema associated with the use of pregabalin: a systematic review. Syst Rev [Internet]. 2013;2:25.
- Gallagher R, Apostle N. Peripheral edema with pregabalin. CMAJ [Internet]. 2013;185(10):E506.
- COX-2 inhibitors: pharmacological data and adverse effects – Minerva Anestesiologica 2005;71(7-8):461-70 – Minerva Medica – Journals.
- Griffin MR, Yared A, Ray WA. Nonsteroidal Antiinflammatory Drugs and Acute Renal Failure in Elderly Person; 2000 Mar 1;151(5):488-96.
- Schneider V, Lé Vesque LE, Zhang B, Hutchinson T, Brophy JM. Original Contribution Association of Selective and Conventional Nonsteroidal Antiinflammatory Drugs with Acute Renal Failure: A Population-based, Nested Case-Control Analysis. Am J Epidemiol. 2006;164(9):881-9.
- Moore N, Pollack C, Butkerait P. Therapeutics and Clinical Risk Management Dovepress Adverse drug reactions and drug-drug interactions with over-the-counter NSAiDs. Ther Clin Risk Manag 2015;11–1061.
- Prieto-García L, Pericacho M, Sancho-Martínez SM, Sánchez Á, Martínez-Salgado C, López-Novoa JM, et al. Mechanisms of triple whammy acute kidney injury. Pharmacol Ther [Internet]. 2016 Nov 1; 167:132–45.
- Birks J. Cholinesterase inhibitors for Alzheimer’s disease. Cochrane Database Syst Rev [Internet]. 2006 ;(1).
- Connelly PJ, Adams F, Tayar ZI, Khan F. Peripheral vascular responses to acetylcholine as a predictive tool for response to cholinesterase inhibitors in Alzheimer’s disease. BMC Neurol [Internet]. 2019;19(1):1–7.
- Kálmán J, Szakács R, Török T, Rózsa Z, Barzó P, Rudas L, et al. Decreased cutaneous vasodilatation to isometric handgrip exercise in Alzheimer’s disease. Int J Geriatr Psychiatry [Internet]. 2002;17 (4): 371–4.
- Maltz JS, Eberling JL, Jagust WJ, Budinger TF. Enhanced cutaneous vascular response in AD subjects under donepezil therapy. Neurobiol Aging. 2004;25:475–81.
- Elmahal ME, Ramadan MM. Insulin-Induced Edema in a Patient with Type 2 Diabetes Mellitus. Am J Case Rep [Internet]. 2021;22(1):e931960-1.
- Wong M, Balakrishnan T. Anasarca in Newly Diagnosed Type 1 Diabetes: Review of the Pathophysiology of Insulin Edema. Cureus [Internet]. 2020;12(3).
- Crawford P, Crawford AJ. Edema from Taking Cinnamon for Treatment of Diabetes: Similar Biochemistry and Pathophysiology to Thiazolidinedione Medications. J Am Board Fam Med [Internet]. 2018 ;31(5):809–11.
- Goltsman I, Khoury EE, Winaver J, Abassi Z. Does Thiazolidinedione therapy exacerbate fluid retention in congestive heart failure? Pharmacol Ther [Internet]. 2016 [cited 2022 Jan 16]; 168:75–97.
- Carballo-Rodríguez A, Gómez-Salgado J, Casado-Verdejo I, Ordás B, Fernández D, Carballo-Rodríguez A, et al. Estudio de prevalencia y perfil de caídas en ancianos institucionalizados. Gerokomos [Internet]. 2018;29(3):110–6.
- Patel C, Wyne KL, McGuire DK. Thiazolidinediones, peripheral oedema and congestive heart failure: What is the evidence? Diabetes Vasc Dis Res [Internet]. 2005;2(2):61–6.
